Химия традиционно входит в число лидеров среди предметов ЕГЭ по выбору. Будущим абитуриентам крайне важно детально понимать формат экзамена и характер заданий.
Структура заданий ЕГЭ по химии

Задания первой части ЕГЭ по химии
Первая часть экзамена направлена на оценку базового владения предметными понятиями и навыков интерпретации информации (таблицы, схемы, графики). Успешное выполнение требует чёткого понимания специфики каждого задания. Детальный разбор их структуры, типовых требований и алгоритмов решения – ключ к эффективной подготовке и формированию прочной основы для сложных задач.
Задания 1-3 ЕГЭ по химии
Эти задания включают в себя теорию о современной модели строения атома.
Например:

Чтобы правильно выполнить для начала нужно записать электронную конфигурацию атома для каждого элемента в основном (невозбужденном) состоянии, а также:
- использовать порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p и т.д;
- учесть исключения: элементы, у которых наблюдается «проскок» электрона для достижения более устойчивого состояния;
- посчитать общее число электронов;
- сравнить результаты: найти два элемента с одинаковым общим числом p-электронов.
Задание 4 ЕГЭ по химии
Проверяются знания о видах химической связи и механизмах ее образования.
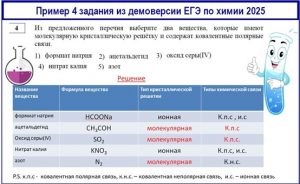
Здесь может возникнуть путаница между типом связи и типом решетки: самая распространенная ошибка — считать, что ковалентные связи автоматически означают молекулярную решетку. Это не так!
Вещества с ковалентными связями могут иметь:
- молекулярную решетку (I₂, CO₂, H₂O, CH₄) — если это отдельные молекулы;
- атомную решетку (алмаз C, SiO₂) — если атомы связаны в бесконечную сеть;
- ионную решетку (соли: NaNO₃, K₂CO₃) — если есть ионы (но внутри иона связи ковалентные полярные!).
Обязательно нужно запомнить исключения:
- алмаз/графит (C): к.н.с. + атомная решетка;
- кварц (SiO₂): к.п.с. + атомная решетка;
- соли (NaCl, KNO₃): к.п.с. (внутри иона) + и.с. (между ионами) + ионная решетка;
- щелочи (NaOH): к.п.с. (O-H) + и.с. (Na⁺…OH⁻) + ионная решетка;
- простые вещества (N₂, O₂): к.н.с. + молекулярная решетка.
Задание 5 ЕГЭ по химии
Направлено на проверку навыков анализа и интерпретации классификации неорганических веществ.

Основания — вещества, состоящие из катиона металла и гидроксид-аниона OH⁻. Формулы вида Me(OH)ₓ.
Основные соли (содержащие OH⁻) основаниями не являются!
Соли сильной кислоты — соли, образованные катионом металла (или NH₄⁺) и анионом сильной кислоты (HCl, HBr, HI, HNO₃, HClO₄, H₂SO₄).
Сила кислоты определяет, насколько полно соль гидролизуется.
Кислотный оксид — оксид, который реагирует с основаниями (или основными оксидами) с образованием соли. Обычно образован неметаллом (или металлом в высокой степени окисления).
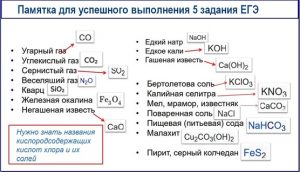
Задание 6-8 ЕГЭ по химии
Проверяют знание химических свойств основных классов неорганических соединений (оксидов, гидроксидов, металлов, солей), умение записывать уравнения реакций и определять продукты, особенно в окислительно-восстановительных процессах.
Вспомните типичные реакции:
- оксиды с кислотами;
- гидроксиды с кислотами (реакция нейтрализации);
- металлы с кислотами-окислителями (HNO₃ конц., H₂SO₄ конц.);
- взаимодействие солей (реакции обмена или ОВР, если есть окислитель и восстановитель).

Задание 9 и 16 ЕГЭ по химии
Эти два вопроса предусматривают рассмотрение генетической связи между классами органических и неорганических веществ.


Запомните ключевые свойства реагентов:
- кислоты (HNO₃, H₂SO₄): реагируют с металлами с образованием солей;
- O₂: основной окислитель для получения оксидов металлов из простых веществ;
- H₂: основной восстановитель для получения металлов или их низших оксидов из высших оксидов;
- CO₂: не является сильным окислителем, не реагирует с железом.
Задание 10 ЕГЭ по химии
Вопросы о классификации органических веществ.

Решение:
- бутадиен-1,3 — диеновый углеводород, 2-метилпропанол-1 — первичный спирт, этилформиат — сложный эфир.
Ответ: 432.
Выучите ключевые суффиксы:
- алканы: -ан (метан, этан);
- алкены: -ен (этен, бутен);
- алкадиены: -диен (бутадиен);
- алкины: -ин (этин, бутин);
- арены: названия типа «бензол», «толуол»;
- спирты: -ол (метанол, этанол, пропанол);
- простые эфиры: Названия типа «диэтиловый эфир», «метиловый этиловый эфир» (суффикса нет!);
- сложные эфиры: -оат / -ат (метилоат этановой кислоты → метилацетат; этил формиат );
- карбоновые кислоты: -овая кислота (метановая кислота, этановая кислота).
Обращайте внимание на структуру названия:
- названия сложных эфиров состоят из двух слов: названия алкильного радикала спирта + название кислотного остатка (формиат, ацетат, пропионат, бензоат и т.д.);
- названия спиртов всегда содержат суффикс «-ол» и цифру, указывающую положение -OH группы (пропанол-1).
Задание 11 ЕГЭ по химии
Проверяет знание основных положений теории химического строения органических соединений А.М. Бутлерова.
Пример:


Помните исключения:
- углеводороды (бензол, толуол, метан) не имеют функциональных групп;
- OH в спиртах и фенолах формально одинаковая группа.
Задание 12 и 15 ЕГЭ по химии
Учитывает знания классических органических реакций, умение определять необходимые реагенты (X) для проведения конкретных превращений.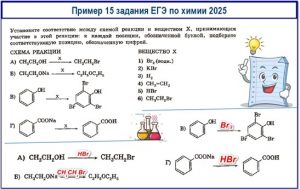
Учитесь определять тип реакции:
- замена функциональной группы (например, -OH на -Br);
- реакция этерификации (образование сложного эфира);
- реакция дегидратации (отщепление воды);
- реакция гидролиза (разложение водой);
- реакция Вильямсона (синтез простого эфира);
- реакция соли карбоновой кислоты.
Задание 17 и 19 ЕГЭ по химии
Проверка умения применять правила воздействия на скорость реакции. Составлять уравнения реакции.


Вспомните закон действующих масс для реакций! Выучите факторы скорости и их влияние.
Тренируйтесь на реакциях с разными агрегатными состояниями:
- гомогенные (газ-газ, раствор-раствор): концентрации, температура, давление (газы);
- гетерогенные (твердое-газ, твердое-жидкость): площадь поверхности, концентрация жидкого/газообразного реагента, температура.
Задание 20 и 23 ЕГЭ по химии
Направлены на умения применения правил электролиза, гидролиза; составления обратимых и необратимых реакций.


Запомните правила гидролиза, электролиза солей. Выучите сильные основания: щелочи (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)₂, Ba(OH)₂) → pH ≈ 12-14.
Типичные соли:
- кислая среда: AlCl₃, FeCl₃, CuSO₄, NH₄NO₃;
- щелочная среда: Na₂CO₃, K₂S, NaF;
- нейтральная среда: NaCl, Ba(NO₃)₂, K₂SO₄.
Задание 24 ЕГЭ по химии
Требуется глубокое понимание различия веществ в парах на основе их химических свойств.
Пример:


Важно уметь определять разницу в свойствах (кислотность, окислительно-восстановительные свойства).
Задание 25 ЕГЭ по химии
Направлено на практическое применения ключевых неорганических и органических веществ.

Вспомните область применения веществ:
- А) Аммиак (NH₃): основное применение — производство азотных удобрений (нитрат аммония, карбамид);
- Б) Метан (CH₄): основное применение — топливо (бытовой газ, сырье для энергетики);
- В) Изопрен (C₅H₈): мономер для синтеза синтетического каучука (полиизопрен);
- Г) Этилен (C₂H₄): сырье для производства пластмасс (полиэтилен), растворителей, этилового спирта.
Задание 26 и 28 ЕГЭ по химии
Это типичные задачи с кратким ответом.


Алгоритм решения заданий 26-28 в ЕГЭ по химии:
- записать дано и формулу;
- перевести проценты в доли: 25% → 0.25, 40% → 0.4;
- подставить значения в формулу, которая приведена в решении.
Разбор второй части читайте здесь.
Мечтаете поступить в медицинский институт или связать свою жизнь с биологией? «ПедСистема» — это центр подготовки к ЕГЭ и ОГЭ, организованный на базе медицинского института, поэтому у вас есть уникальная возможность заниматься в специализированных кабинетах химии и биологии. Здесь вас обеспечат практическими навыками и глубокими знаниями, недоступными на обычных курсах.
Запись по телефону: 8 (800) 100 59 38.